Nilai Darah
Nilai Darah
Blood Value
Zarfania Shalihat1)*) Ratna Juwita Tasman2) Ilham Kurniawan3) Riri Tuningsih4) Yuyun Tusiah5)
1) NIM. 1310422037, Kelompok 8A, Praktikum Fisiologi Hewan
2) NIM. 1310421074, Kelompok 8A, Praktikum Fisiologi Hewan
3) NIM. 1310421017, Kelompok 8A, Praktikum Fisiologi Hewan
4) NIM. 1310421044, Kelompok 8A, Praktikum Fisiologi Hewan
5) NIM. 1310421037, Kelompok 8A, Praktikum Fisiologi Hewan
*Koresponden: zarfaniashalihat9@gmail.com
ABSTRACT
Blood is the transport medium of cells that carries O2, CO2, and the food in the body. Mnegenai lab blood value is intended to determine the method and technique of measuring the value of the blood (blood value) standard which includes the value of hematocrit, number of erythrocytes and leukocytes and hemoglobin concentration of the blood as well as understanding and interpreting blood values corresponding physiological concepts. This lab held on Wednesday November 11 2015 in the Laboratory of Education II, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Andalas, Padang. From the lab has done showed that; the quantity of erythrocytes in Bufo sp is 350,000 mm3dan on Mus musculus is 980,000 mm3, the quantity of leukocytes in Bufo sp. namely 25,800 mm3 and the Mus musculus is 8.400 mm3, the Bufo sp hematocrit value is 18% and at 15% Mus musculus, hemaglobin levels in Bufo sp. ie 3 g / dL and hemoglobin of Mus musculus is 3.4 g / dL, the value of MCV in Bufo sp. namely 514.28 fl and the Mus musculus is 153.06 fl, MCH value in Bufo sp. ie 85.71 pg and the Mus musculus is 3.69 pg, while the value of MCH on Bufo sp. namely 16.67 g / dL and the Mus musculus is 22.67 g / dL.Keywords : Bloodvalue, Hematocrit, Hemoglobin
PENDAHULUAN
Darah merupakan suatu jaringan bersifat cair yang terdiri dari sel- sel dan pigmen- pigmen sel. Plasma sel merupakan darah yang terdiri dari sel-sel yang bebas dalam medium seperti air Fragmen- fragmen sel merupakan unsur- unsur darah yang disebut dengan unsur “jadi”, sel – sel ini cukup besar sehingga dapat diambil dengan mikroskop biasa (Wattimena, 1990).
Darah berperan sebagai medium pertukaran antara sel-sel yang terfiksasi dalam tubuh dan lingkunagn luar serta bersifat protektif terhadap organisme. Darah juga berperan dalam mempertahankan homeostatis dan menjaga keseimbanagn fungsi-fungsi organ tubuh agar dapat berjalan dengan baik (Baldy, 1995).
Menurut Nurdin (1997), menyatakan bahwa fungsi dan peranan darah bagi manusia antara lain: sebagai alat pengangkut bermacam-macam substansi O2, CO2, nutrisi, garam-garam, hormon dan enzim. Memilki kemampuan koagulasi dan komposisi kimia darah. Sebagai tempat terlarut bahan yang diangkut, transpor hormon dan metabolisme, mengatur suhu tubuh dan sebagainya.
Terdapt tiga tipe unsur jadi darah, yaitu sel-sel darah merah, (eritrosit), sel-sel darah putih (leukosit), dan keping-keping darah (trombosit). Diantara ketiga tipe tersebut unsur-unsur jadi tersebut sel darah merah merupakan unsur yang paling banyak jumlahnya (Kimball, 1998).
Sel darah merah dapat diukur dengan proses pengenceran. Salah satunya dengan menggunakan pipet pengencer Thoma. Kamar hitung dibuat dari gelas yang tebal berbentuk kotak yang satu sama lainnya dipisah oleh parit berbentuk huruf H, daerah berkotak ini mempunyai kedalaman 0,1 mm. Setiap kotak besar terdiri dari 25 kotak kecil lalu jumlah darah dihitung dibawah mikroskop. Larutan pengencer yang digunakan yaitu larutan NaCl 0,9%, toison dll (Wulangi, 1990).
Sel putih merah alam tubuh berjumlah paling sedikit. Sel darah putih memiliki inti. Sel darah putih berperan melindungi tubuh dari infeksi. Nanah merupakan sel darah yang mati dan juga merupakan hasil kerusakan jaringan. Sel darah putih (leukosit) akan terlihat jelas apabila diwarnai dengan hematoksilin dan eosin dibanding sel darah merah. Sebagai larutan pengencer dipakai larutan yang punya kemampuan menghaemolisis SDM dan berisi pewarna anline, serta harus bening (Kimball, 1996).
Leukosit berbeda dari eritrosit karena jumlahnya sedikit dan mempunyai inti. Fungsi leukosit melindungi badan dari infeksi. Leukosit akan terlihat jelas apabila diwarnai dengan hematoksilin dan eosin dibandingkan sel darah merah. Sintesis leukosit berlangsung di tempat yang berbeda yaitu untuk kelompok granulosit disintesis di sumsum merah tulang sedangkan kelompok agranulosit (monosit dan limfosit) disintesis di nodus limfatikus (Kimball, 1996).
Selain sel darah putih dan sel darah merah, di dalam darah juga terdapat hemoglobin. Hemoglobin merupakan suatu bentuk protein yang kaya akan zat besi. Hemoglobin memiliki daya gabung (afinitas) tinggi terhadap oksigen. hemoglobin membawa oksigen dari paru-paru keseluruh jaringan tubuh dan membawa kembali karbondioksida dari seluruh sel ke paru-paru yang kemudian dikeluarkan dari dalam tubuh. Hemoglobin pada hewan vertebrata ditemukan pada eritrosit (Bavelender dan Romaley,1998)
Keistimewaan hemoglobin berikatan dengan O2 membentuk oksihemoglobin dimana ikatan ini bisa lepas apabila O2menurun. Pembentukan heme pada manusia terjadi di ribosom dan reticulosit. Sintesisnya dimulai dari sel eritroblast , tetapi kadang-kadang masih dilanjutkan untuk beberapa hari dalam sel darah merah yang baru dilepaskan dari sum-sum tulang ke dalam peredaran darah. Hemoglobin dapat mengikat oksigen. Dalam satu gramnya dapat mengikat O2 sebanyak 1,34 ml (Dahelmi, 1991).
Menurut Wulangi (1990) penentuan kadar Hemoglobin dalam darah dapat dilakukan dengan beberapa cara : 1) metoda hematin asam (metoda sahli). Pada metoda ini dilakukan dengan mencampurkan HCl 0,1 N, maka Hemoglobin akan berubah menjadi hematin asam berwarna coklat. Reaksinya dilakukan dalam sebuah tabung. Dari tingginya kolom campuran dalam tabung dapat ditentukan kadar Hb. 2). Metoda kimia. Pada metoda ini kadar hemoglobin dapat ditentukan dengan cara menetukan jumlah Fe yang ada dalam darah terlebih dahulu. Fe dan Hb dipisahkan dengan H2SO4.
Adapun tujuan dari praktikum nilai darah ini adalah untuk mengetahui metode dan teknik pengukuran nilai darah (blood value) standar yang meliputi nilai hematokrit, jumlah eritrosit dan leukosit serta kadar Hb darah serta memahami dan menginterpretasikan nilai darah sesuai konsep-konsep fisiologis.
PELAKSANAAN PRAKTIKUM
Waktu dan Tempat
Praktikum nilai darah dilaksanakan pada hari Rabu, 11 November 2015 pukul 13.00 - 15.30 WIB di Laboratorium Pendidikan II Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Andalas, Padang.
Alat dan Bahan
Adapun alat yang digunakan adalah pipet kapiler, apendorf, standar skala Sahli, pipet thoma, pipet eritrosit, pipet leukosit, tabung reaksi, pipet tetes, hemositometer, skala hematokrit, suntik, gunting bedah, jarum bedah, bak bedah, mikroskop dan sentrifus. Adapun bahan yang digunakan yaitu Rana sp, Mus musculus, larutan Hayem, larutan Turk, EDTA 10%, HCl dan aquadest.
Cara Kerja
1. Pengambilan Sampel Darah
Untuk pengambilan sampel darah pada Rana sp. dilakukan decapitasi terlebih dahulu pada bagian leher menggunakan gunting, kemudian ambil darah menggunakan jarum suntik dan masukkan kedalam apendorf. Untuk pengambilan sampel darah pada Mus musculus, dilakukan dislokasi vertebrae terlebih dahulu untuk mematikan hewan tersebut, kemudian bedah perut hewan ini hingga tampak organ bagian dalam, selanjutnya ambil darah pada bagian jantung menggunakan jarum suntik dan masukkan kedalam apendorf.
2. Menghitung Jumlah Sel Darah (Eritrosit dan Leukosit)
Menghitung Jumlah Eritrosit
Dilakukan pengambilan sampel darah dengan suntikan yang telah dibilas dengan EDTA 10% dan dimasukkan ke dalam tabung sampel darah yang juga telah dibilas dengan EDTA. Selanjutnya disiapkan pipet thoma dari kit hemositometer, isap sampel darah dengan menggunakan pipet tersebut hingga skala 0.5, dengan menggunakan pipet yang sama, hisaplah larutan hayem secara hati-hati hingga larutan dalam pipet mencapai skala 101. Hindari adanya gelembung udara. Pegang pipet secara horizontal lalu aduk pelan-pelan dengan digoyangkan pipet beberapa kali hingga larutan menjadi homogen. Setelah homogen lalu disediakan hemositometer yang bersih, tutup dengan kaca penutupnya secara benar hingga saling berlekatan satu sama lain. Kemudian dipipetkan sampel dalam pipet thoma dengan menggunakan kontrol ujung jari pada bagian pangkal pipet dan dibiarkan larutan mengalir memenuhi ruang dalam hemositometer. Hindari volume yang berlebihan. Setelah itu, dibiarkan sample tersebut selama 2-3 menit lalu letakkan di mikroskop dan hitung jumlah eritrosit yang terlihat pada lima kotak menengah. Disajikan data dalam bentuk grafik perbandingan antar spesies.
Kuantitas eritrosit yang sebenarnya dihitung dengan rumus :
Kuantitas eritrosit yang sebenarnya dihitung dengan rumus :
Dimana :
SDM : Kuantitas eritrosit per mm3
Ne : Kuantitas eritrosit yang terhitung
P : Angka pengenceran (200 kali)
P : Angka pengenceran (200 kali)
0,02 : Volume total darah dalam lima kotak yang dihitung.
Menghitung Jumlah Leukosit
Diambil sampel darah sama dengan prosedur pada penghitungan eritrosit. Lalu dengan digunakan pipet thoma untuk leukosit, sampel darah dihisap hingga skala 0.5 lalu dibersihkan bagian luar pipet dengan tissue atau kapas dan dilanjutkan dengan menghisap larutan turk hingga skala 101. Dipegang pipet secara horizontal lalu digoyangkan pelan-pelan hingga larutan homogen. Kemudiah disediakan hemositometer yang bersih dan tutup dengan kaca penutupnya hingga saling berlekatan dan dengan pelan-pelan, dialirkan sampel dari pipet ke ruang dalam hemositometer hingga memenuhi seluruh ruangan (hindari kelebihan volume). Dibiarkan 2-3 menit lalu diletakkan di mikroskop dan dihitung jumlah leukosit yang terlihat pada 4 kotak besar pada hemositometer. Kuantitas leukosit yang sebenarnya dapat dihitung dengan rumus berikut ini :
Dimana :
SDP : Kuantitas leukosit per mm3
Ni : Kuantitas leukosit yang terhitung
P : Angka pengenceran (20 kali)
0,4 : Volume total darah yang dihitung
3. Menghitung Nilai Hematokrit (Packed Cell Volume, PCV)
Dilakukan pengambilan sampel darah dengan memipetkan tabung hematokrit dengan jari pada bagian pembuluh darah atau jantung hewan yang telah ditentukan atau dapat juga dengan memipetkan sampel darah yang telah ditampung dalam tabung sampel darah. Tabung hematokrit diisi hingga lebih dari setengahnya, tetapi jangan sampai penuh. Kemudian ditutup salah satu lubang tabung dengan penutupnya dan diletakkan pada sentrifus secara tepat. Lalu dilakukan sentrifugasi terhadap sampel darah dengan kecepatan 100 rpm selama 15 menit. Setelah disentrifus, angkat tabung secara cermat dan dihitung kadar hematokrit dengan menggunakan skala hematokrit dan dinyatakan dalam persen dan diajikan data dalam bentuk grafik perbandingan antar spesies.
4. Menghitung Kadar Hemoglobin Dengan Metode Sahli
Disediahkan sampel darah hewan percobaan dan ditampung dalam tabung sampel darah yang telah dibilas EDTA 10%. Kemudian dimasukkan 5 tetes HCl 0.1 N ke dalam tabung pengencer hemometer. Selanjutnya sampel darah diisap dengan menggunakan pipet hemoglobin sampai garis tanda 20 ul dan dihapus sisa darah yang melekat di luar ujung pipet. Lalu dialirkan sampel darah tersebut ke dalam tabung hemometer dan jangan sampai ada gelembung udara Jangan lupa catat waktu pertama memasukkan sampel tersebut ke dalam tabung, setelah itu dibilas pipet tersebut secara cermat dengan HCl yang ada didalam tabung untuk membersihkan sisah sampel darah yang masih ada didalamnya. Kemudian diaduk campuran darah tersebut hingga homogen dan larutan menjadi coklat tua. Setelah itu ditambah aquades setetes demi setetes dan diaduk dengan batang pengaduk dengan terus memperhatikan warna larutan hingga tercapai kesamaan warna dengan warna standar yang ada pada hemometer Sahli. Persamaan warna larutan dengan warna standar harus dicapai dalam waktu 3-5 menit setelah saat darah dan HCl bercampur (saat memasukkan sampel darah ke dalam tabung). Dibaca kadar hemoglobin darah dengan menggunakan skala yang ada ditabung dalam satuan g/dl dan disajikan data dalam bentuk grafik perbandingan antar spesies.
5. Analisis Indeks Absolut Darah (Absolute Indices)
Mean Corpuscular Volume (MCV; volume rata-rata per unit eritrosit)
(Nabib dan Pasaribu, 1989)
Mean Corpuscular Hemoglobin (MCH; berat hemoglobin rata-rata per unit eritrosit)
(Nabib dan Pasaribu, 1989).
Mean Corpuscular Hemoglobin Concentration (MCHC, konsentrasi Hb rata-rata per satuan total volume eritrosit)
(Nabib dan Pasaribu, 1989)
HASIL DAN PEMBAHASAN
Berdasarkan praktikum yang telah dilaksanakan, maka didapatkan hasil sebagai berikut :
1. Jumlah Sel Darah (Eritrosit dan Leukosit)
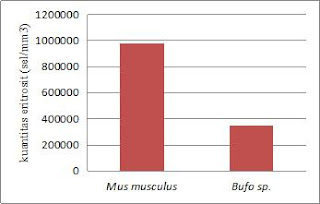
Tabel 1. Kuantitas Eritrosit pada Rana sp. dan Mus musculus
Parameter
|
Bufo sp.
|
Mus musculus
|
Jumlah eritrosit (/mm3)
|
350.000
|
980.000
|
Grafik 1. Kuantitas Eritrosit pada Rana sp dan Mus musculus
Berdasarkan tabel dan grafik diatas mengenai kuantitas eritrosit pada Bufo sp. dan Mus musculus, maka dapat diketahui bahwa kuantitas eritrosit pada Mus musculus lebih tinggi dibanding kuantitas eritrosit pada Bufo sp. hal ini sesuai menurut literatur yaitu menurut Guyton (1976), yang menyatakan bahwa hewan yang aktif bergerak memiliki eritrosit yang banyak, karena hewan yang aktif bergerak laju respirasinya juga semakin cepat sehingga akan mengikat oksigen lebih banyak. Mencit lebih aktif daripada Katak.
Perbedaan kuantitas eritrosit dapat disebabkan oleh beberapa faktor internal dan faktor eksternal. Faktor eksternal yang memepengaruhi kuantitas eritrosit antara lain seperti kondisi lingkungan dan musim, sedangkan faktor internalnya antara lain yaitu; umur, berat badan, massa tubuh, dan jenis kelamin.
Tabel 2. Kuantitas Leukosit pada Rana sp. dan Mus musculus.
Parameter
|
Rana sp.
|
Mus musculus
|
Jumlah eritrosit (/mm3)
|
25800
|
8400
|
Grafik 2. Kuantitas Leukosit pada Bufo sp. dan Mus musculus
Dari tabel dan grafik diatas dapat disimpulkan bahwa kuantitas leukosit katak lebih tinggi dibandingkan dengan kuantitas leukosit pada Mencit. Halini sesuai menurut literatur yaitu menurut Hoffbrand dan Pettit (1987), yang menyatakan bahwa kuantitas leukosit pada mamalia lebih besar dibandingkan kuantitas leukosit pada amfibi.
Menurut Gul et al (1989), meyatakan bahwa terdapat beberapa faktor yang mempengaruhi kadar kuantitas leukosit pada hewan, diantaranya yaitu suhu yang tinggi. Organisme patogen akan berkembang lebih cepat sehingga untuk mengatasi hal tersebut tubuh akan menghasilkan leukosit yang lebih banyak.
2. Nilai Hematokrit (Packed Cell Volume, PVC)
Dari percobaan yang telah dilakukan didapatkan hasil sebagai berikut ;
Tabel 3. Kadar Hematokrit pada Bufo sp. dan Mus musculus
Parameter
|
Bufo sp.
|
Mus musculus
|
Nilai hematokrit (%)
|
18%
|
15%
|
Grafik 3. Perbandingan Nilai Hematokrit Bufo sp. dan Mus musculus
Dari tabel dan grafik diatas mengenai perbandingan nilai heamtokrit pada katak dan mencit daat diketahui bahwa nilai hematokrit pada katak lebih tinggi dibandingkan nilai hematokrit pada mencit. Hal ini sesuai dengan literatur, yaitu menurut Bryon (1983), yang menyatakan bahwa nilai hematokrit pada amfibi lebih tinggi dibandingkan nilai hematokrit pada mamalia. Menurut Ganong (1995), nilai hematokrit dipengaruhi oleh ukuran dan jumlah eritrosit.
Dari tabel dan grafik diatas mengenai perbandingan nilai heamtokrit pada katak dan mencit daat diketahui bahwa nilai hematokrit pada katak lebih tinggi dibandingkan nilai hematokrit pada mencit. Hal ini sesuai dengan literatur, yaitu menurut Bryon (1983), yang menyatakan bahwa nilai hematokrit pada amfibi lebih tinggi dibandingkan nilai hematokrit pada mamalia. Menurut Ganong (1995), nilai hematokrit dipengaruhi oleh ukuran dan jumlah eritrosit.
3. Kadar Hemoglobin dengan metode Sahli
Berdasarkan praktikum yang telah dilakuakn didapatakan hasil sebagai berikut;
Tabel 4. Kadar hemoglobin pada Bufo sp. dan Mus musculus
Parameter
|
Bufo sp.
|
Mus musculus
|
Kadar hemoglobin (g/dL)
|
3
|
3,4
|
Grafik 4. Kadar Hemoglobin pada Bufo sp. dan Mus musculus
Berdasarkan tabel dan grafik diatas mengenai kadar hemoglobin pada katak dan mencit dapat dismpulkan bahwa kadar hemoglobin pada mencit lebih tinggi daripada kadar hemoglobin pada katak. Hal ini tidak sesuai dengan literatur yaitu menurut Mayer dan Harvey (2004), yang menyatakan bahwa kadar hemoglobin sejalan dengan nilai yang didapatkan pada kuantitas eritrosit dan hematokritnya. Jumlah eritrosit, nilai hematokrit dan kadar hemoglobin berjalan sejajar satu sama lain apabila terjadi perubahan. Pada katak memiliki nilai eritrosit dan hematokrit yang tertinggi, sedangkan pada mencit kadar eritrosit dan nilai hematokritnya merupakan yang terendah.
Menurut Hardi dkk (2011), kadar hemoglobin yang rendah dapat dijadikan sebagai petunjuk mengenai rendahnya kandungan protein pakan, defisiensi vitamin atau hewan tersebut terkena infeksi. Kadar Hb berkaitan dengan keseimbangan osmolariats plasma darah. Rendahnya kadar Hb menyebabkan laju metabolisme menurun dan energi yang dihasilkan menjadi rendah.
4. Analisis Indeks Absolut Darah (Absolut Indices)
Dari percobaan yang telah dilakukan didapatkan hasil sebagai berikut;
Tabel 5. Analisis Indeks Absolut Darah
Parameter
|
Rana sp.
|
Mus musculus
|
MCV (fl)
|
514,28
|
153,06
|
MCH (pg)
|
85,71
|
34,69
|
MCHC (g/dL)
|
16,67
|
22,67
|
Grafik 5. Analisis MVC (fl) Bufo sp. dan Mus musculus
Grafik 6. Analisis MCH (pg) Rana sp. dan Mus musculus
Grafik 7. Analisis MCHC (pg) Rana sp. dan Mus musculus
Berdasarkan tabel dan grafik diatas maka dapat dilihat bahwa indeks absolut darah pada Mus musculus lebih tinggi daripada Rana sp.
Nilai MCV pada Bufo sp. lebih tinggi dibandingkan Mus musculus Hal sesuai dengan literatur. Menurut pendapat Hickman and Andrew (1974), jumlah eritrosit Mus musculus lebih besar dari pada jumlah eritrosit Bufo sp. sehingga menyebabkan nilai MCV Bufo sp. lebih besar daripada nilai MCV pada Mus musculus. karena jumlah eritrosit berbanding terbalik dengan MCV.
Nilai MCH pada Bufo sp. lebih tinggi daripada Mus musculus Menurut Simmons (1980), MCH akan meningkat selaras dengan peningkatan ukuran eritrosit (MCV) dan begitu juga sebaliknya. Kenaikan MCH dekat hubungannya dengan peningkatan MCV.
Nilai MCHC pada Mus musculus lebih tinggi daripada Bufo sp. Hal ini sesuai dengan literratur, yaitu menurut Coppo et al (2005), yang menyatakan bahwa konsentrasi hemoglobin (MCHC) pada mamalia lebih tinggi daripada konsentrasi hemoglobin pada amfibi.
KESIMPULAN
Berdasarkan uraian diatas, dapat disimpulkan:
1. Nilai eritrosit Bufo sp. yaitu 350.000 sel/mm3, sedangkan eritrosit Mus musculus yaitu 980.000 sel/mm3. leukosit (sel darah putih) Mus musculus yaitu 8400 sel/mm3 sedangkan leukosit Bufo sp. yaitu 25800 sel/mm3. Kadar hemoglobin Bufo sp. yaitu 3 g/dl sedangkan kadar gemoglobin Mus musculus yaitu 3,4 g/dl. Nilai hematokrit Bufo sp. yaitu 18% sedangkan hematokrit Mus musculus yaitu 15%.
2. Indeks absolute darah Bufo sp. yaitu MCV (fl) = 514,28; MCH (pg) = 85,71; dan MCHC (g/dL) = 16,67. Sedangkan pada Mus musculus yaitu MCV (fl) = 153,06; MCH (pg) = 34,69; dan MCHC (g/dL) = 22,67.
DAFTAR PUSTAKA
Baldy C. M. 1995. Pembekuan. Dalam : Patofisiologi: konsep klinis proses - proses penyakit. Edisi 4. Terjemahan Peter Anugerah. Jakarta: EGC.
Bavelander, G & J. A. Romaley. 1988. Dasar-Dasar Histologi. Erlangga : Jakarta.
Bryon, A. S and S. Doroth. 1983. Text Book of Physiology. St Burst The Moshy Co Toppon Co Ltd. Japan.
Coppo, J. A., B. Norma, Mussart and S. A. Fioranelli. 2005. Blood and urine physiological values in farm-cultured Ranacatesbeiana (Anura: Ranidae) in Argentina
Dahelmi, 1991. Fisiologi Hewan. Universitas Andalas. Padang
Ganong W. F. 1995. Buku Ajar fisiologi Kedokteran (Review of Medical Physiologi). Ed ke-4. Terjemahan P Adianto. EGC Jakarta.
Gul, C., Murat. T., Didem., Eand DO. 2011. Changes in the Blood Composition of Some Anurans. Acta Herpetologica. 6(2): 137-147.
Guyton, A. C. 1976. Text Book of Medical Physiology. W. B. Saunders Company Philadelphia, London.
Hardi, E. H., Sukenda., E.Harris dan A. Lusiastuti 2011. Karakteristik dan Patogenisitas Streptococcus agalactiae Tipe β-hemolitik dan Nonhemolitik pada Ikan Nila. Jurnal Veteriner Vol. 12. 152-164.
Hardi, E. H., Sukenda., E.Harris dan A. Lusiastuti 2011. Karakteristik dan Patogenisitas Streptococcus agalactiae Tipe β-hemolitik dan Nonhemolitik pada Ikan Nila. Jurnal Veteriner Vol. 12. 152-164.
Hickman and Andrew. 1974. Histology Of The Vertebrates. The CV Masby Company. Saint.
Hoffbrand, A. V. and J. E. Pettit. 1987. Haematologi. Penerbit ECG. Jakarta.
Kimball, 1996. Biologi. Jilid II. Erlangga. Jakarta
Meyer, D.J. dan J.W. Harvey. 2004. Veterinary Laboratory Medicine Interpretation & Diagnosis. 3rd ed. Saunders, USA.
Nabib, R. dan F. H. Pasaribu. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan dan. Kebudayaan, Direktorat Jendral pendidikan Tinggi. IPB.
Nurdin, MS. 1997. Histologi.UniversitasAndalas. Padang.
Wattimena,JR dan Elin Yuilinah S. 1990. Fisiologi Manusia II Sistem Transfort dan Metabolisme. ITB : Bandung.
Wulangi, S.K. 1990. Fisiologi Peredaran. Institut Teknologi Bandung. Bandung.












0 Response to "Nilai Darah"
Posting Komentar